在生物有機體內,鈣離子傳遞了各種各樣的胞內信號,這些信號幾乎在每種類型的細胞中都存在,而且在很多方面都有非常重要的作用。在很多細胞活動的時候,胞內鈣離子的濃度會顯著升高。鈣離子成像是利用鈣離子特異染料,將細胞中的鈣離子濃度通過熒光強度表現出來,從而達到檢測細胞活動的目的。德國的科學家通過研究B細胞胞質中鈣離子濃度來研究 Rho GTPase Rac 對于B細胞功能的重要影響,研究發現,RacPLCγ2可以通過增強胞漿內的Ca2+濃度來影響B細胞受體(BCR)發揮作用。
文中,研究人員用BCR和Ca2+分別處理DT40 Bcell,觀測DT40B cell中鈣離子的濃度變化。研究人員研究了在這樣的處理下,Unmodified DT40 cells ( PLCγ2+/+), PLCγ2-/- cells,PLCγ2-/- cells stably expressing wild-type 這幾種細胞的鈣離子濃度變化,說明了PLCγ2,Ca2+和BCR之間的關系。
圖一:ibidi六通道載玻片,可見載玻片上有六個平行通道,可以做六組平行實驗。或者用不同的樣本。通道載玻片的特點是單通道容積很小,需要的試劑量只有30μl。其底部可以直接使用油鏡,進行高分辨率成像,光學效果較好。本文中,是使用共聚焦顯微鏡觀測鈣離子染料的熒光值。
一.實驗步驟
1) 使用0.01%(w/v)的多聚L賴氨酸(Poly L-Lysine)對六通道載玻片進行包被
2) 單通道鋪入3×105 DT40 B細胞,37℃,10%CO2環境中孵育45分鐘待細胞貼壁。
3) 使用無細胞培養基,輕輕沖洗通道,移除未貼壁細胞(圖二)。

圖二:沖洗換液方法,藍色代表新的無細胞培養基
4) 用RPMI 1640培養基加入2 µM fluo-4 AM, 0.02 % (v/v)Pluronic® F-127,加入通道中,孵育30分鐘。
5) 用Buffer B沖洗兩次細胞,可以用加入 BCR抗體 anti-IgM或 1 mM CaCl2做為刺激液。
6) 使用共聚焦顯微鏡觀測數據。
一.實驗結果
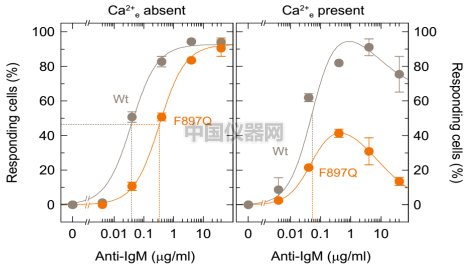
圖三: 由圖中曲線可以看出,在沒有胞外Ca2+存在的時候,對BCR的刺激(加入 BCR抗體 anti-IgM)和B細胞中鈣離子活動成比。而當有胞外Ca2+的時候(加入1mM CaCl2)胞外對于胞內鈣離子的活動也有非常顯著的影響,會隨著Anti-IgM的升高,胞內鈣離子濃度會降低。 |




