免疫熒光技術是在免疫學、生物化學和顯微鏡技術的基礎上建立起來的一項技術。本文章介紹新方法,我們將描述在通道載玻片內培養大鼠成纖維細胞(Rat1)的單個實驗案例。然后,我們用AlexaFluor?488鬼筆環肽染色F-肌動蛋白細胞骨架,并用DAPI對細胞核進行復染。 
ibidi免疫熒光實驗方案主要包括四個主要步驟: 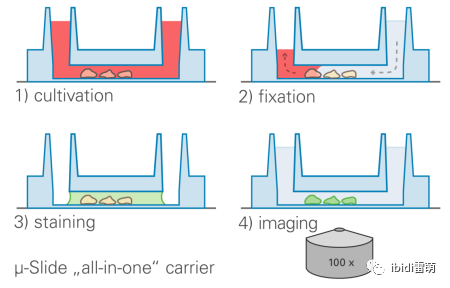
1、培養 ? 在無菌條件下打開 μ-Slide VI 0.4、ibiTreat (80606) 的包裝,并將其放在 μ-Slide 架 (80003) 上。 ? 在每個通道中加入 30 μl 3x105細胞/ml 大鼠成纖維細胞(Rat1)細胞懸液。如下圖所示或我們的網站上所示,直接將移液器加入通道。 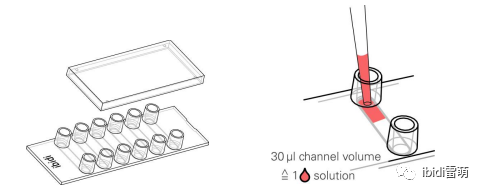
? 用隨附的蓋子蓋住。 ? 將載玻片放入培養箱 (37 °C; 5% CO2) 培養并讓細胞附著 (60 分鐘)。然后用 60 μl 無細胞培養基填充兩個通道口。 ? 孵育過夜。 2、固定和透化 在固定和透化過程中要小心,通道永遠不要變干!通過用下一個沖洗剩余的溶液來交換通道中的液體 固定:使用細胞培養抽吸裝置從所有通道口中吸出培養基。用 Dulbecco PBS 洗滌細胞,方法是將 200 μl 緩慢加入每個通道的一個空通道口,并從每個通道的相對通道口吸出。不要吸出整個通道體積。用約 100 μl 3.7% 多聚甲醛的 PBS 固定細胞。20 分鐘后,通過用 200 μl PBS 填充一孔并從另一孔中吸出來沖洗通道內的液體;確保通道的不干涸。 透化和封閉:如上所述,用 200 μl PBS 再次洗滌細胞。在 PBS 中用 ~100 μl 0.1% Triton? X-100 3-5 分鐘。用 PBS 洗滌細胞。用 ~100 μl 封閉溶液(PBS 中的 1% BSA)20 分鐘。 用 PBS 洗滌細胞。 3、染色 使用抽吸裝置從通道中取出所有液體。不要讓通道變干。吸液后立即加入 30 μl Alexa Fluor? 488 鬼筆環肽(在 200 μl PBS 和 1% BSA 中)。用 1 毫升注射器注射溶液會有所幫助。在室溫下孵育 20 分鐘。用 PBS 洗滌細胞。 用 30 μl DAPI (0.1 μg/ml) 3-5 分鐘。用 PBS 清洗細胞并應用 ibidi 封固培養基,直到通道被填滿(約 50 μl)。ibidi 封固劑以甘油為基礎,并含有用于抗褪色的 DABCO。載玻片可存放約4 周。 4、成像 在熒光顯微鏡下選擇適當的濾鏡,也可以使用浸油觀察細胞。之所能如此簡便完成免疫熒光實驗,是因為這些ibidi培養皿和載玻片的底部為特殊處理的材質,絕大多數細胞可以直接貼壁生長,而不需要另外包被。同時,這些耗材的底部薄如蓋玻片,可以直接使用倒置顯微鏡進行觀察,得到高質量的成像,適用于顯微鏡比如共聚焦顯微鏡。 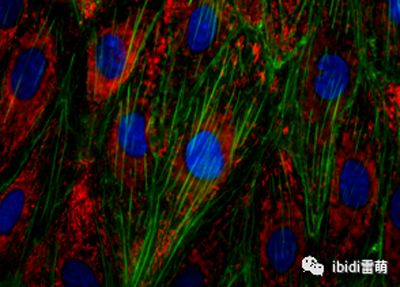
實驗例子: 超分辨率顯微鏡 (STED)觀察肌動蛋白細胞骨架 μ-Slide VI 0.4與超分辨率顯微鏡方法兼容,使用 LifeAct-TagGFP2 蛋白,可以詳細觀察肌動蛋白細胞骨架。在這個實驗中,固定的 Rat1 成纖維細胞與 LifeAct-TagGFP2 蛋白一起在 μ-Slide VI 0.4,ibiTreat中孵育。并用 STED 顯微鏡以創建超分辨率圖像。 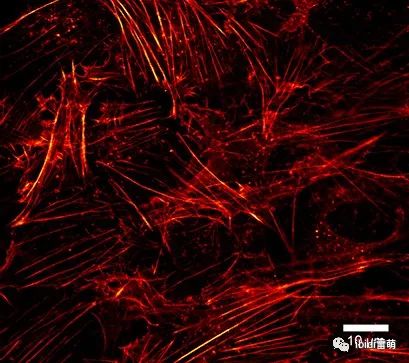
使用LifeAct-TagGFP2 蛋白對 Rat1 成纖維細胞中的肌動蛋白細胞骨架進行超分辨率顯微鏡檢查。使用 Plan-Neofluar 100x/1.4 物鏡在 STEDYCON 超分辨率 STED 納米顯微鏡系統(Abberior Instruments GmbH,德國哥廷根)上進行顯微鏡檢查。 μ-Slide VI 0.4用于獲取人 BJ 成纖維細胞的共聚焦圖像。用 Drp-1 siRNA 轉染細胞并用 MitoTracker Red 染色以觀察線粒體。 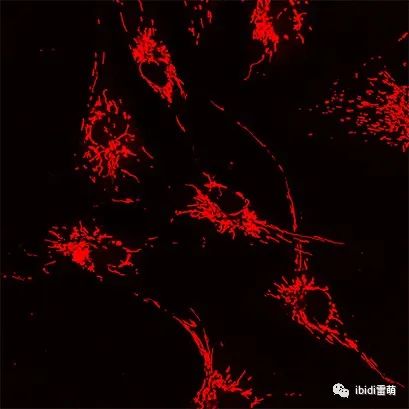
在 ibidi μ-Slide VI 0.4中培養的人 BJ 成纖維細胞的共聚焦顯微鏡圖像。MitoTracker Red(紅色)用于可視化線粒體。圖片由土耳其伊斯坦布爾哈里克大學醫學院的 Fulya Dal Yontem 提供。 用于肌動蛋白可視化的熒光顯微鏡 在這個例子中,A549 細胞(肺泡上皮細胞)在 μ-Slide VI 0.4,ibiTreat上培養,以研究促炎刺激對細胞骨架重排的影響。將細胞暴露于內毒素 (LPS) 中 4 小時,并用熒光鬼筆環肽染色以觀察細胞收縮和細胞間間隙的出現。 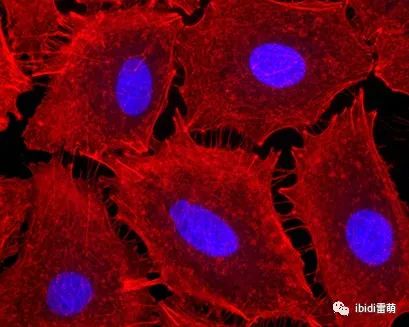
A549 細胞在 μ-Slide VI 0.4、ibiTreat 上生長,暴露于內毒素 (LPS) 4 小時,并用熒光鬼筆環肽染色以檢測細胞肌動蛋白(紅色)。40 倍放大倍率。圖片由美國弗吉尼亞州里士滿弗吉尼亞聯邦大學的 Bernard Fisher 提供。 |




