ibidi μ-Slide Chemotaxis細胞趨化載玻片對嵌入Matrigel?中的HUVEC(人臍靜脈內皮細胞)進行免疫熒光染色的詳細實驗方案;在趨化性細胞向遷移之后,可通過免疫細胞化學染色研究了定向細胞遷移的形態學特征。 
μ-Slide Chemotaxis 實驗材料準備: 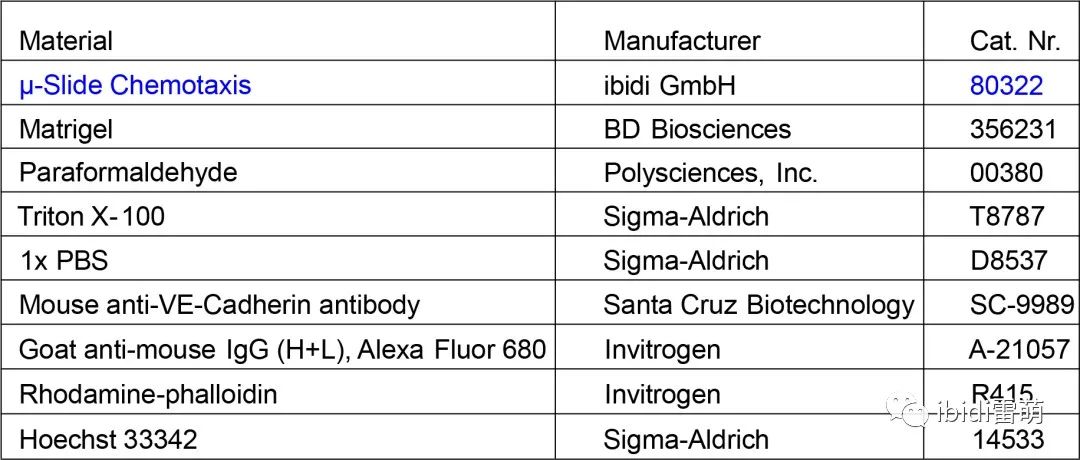
實驗步驟: 把HUVEC接種在50%Matrigel?中,并填充至μ-Slide Chemotaxis中,然后將其沿10%FCS梯度遷移24小時。采用免疫染色法觀察內皮細胞在Matrigel?中定向遷移后的形態學特征。HUVEC的染色是直接在μ-Slide細胞趨化載玻片中進行的。在染色方案的所有步驟中,將60 μl的相應溶液分別添加到兩個大儲液池中。在孵育過程中,所有塞子均保持關閉狀態,以免干擾通過觀察通道的擴散。除非另有說明,否則所有步驟均在室溫下進行。 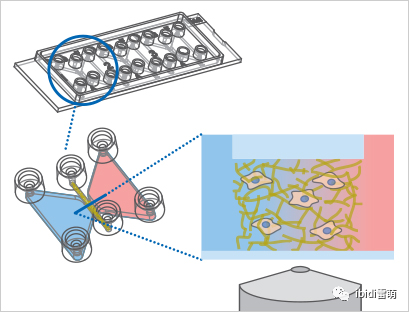
實驗操作流程: 1) 從一邊儲液池中取出塞子,然后吸出培養基。在抽吸和沖洗步驟中,將塞子留在通道中。 2) 用1x PBS洗滌→3x 10分鐘 3) 用4%多聚甲醛固定細胞和基質蛋白→1x 40分鐘 4) 用1x PBS洗滌→2x 10分鐘 5) 用0.2%Triton X-100 / PBS透化細胞→1x 20分鐘 6) 用1x PBS洗滌→6x 10分鐘 7) 用1% BSA/PBS阻斷非特異性抗原→過夜 8) 用1x PBS洗滌→6x 10分鐘 9) 添加一抗:單克隆抗VE鈣黏著蛋白,小鼠(在1%BSA / PBS中為1:100)→在4°C下1x 24小時 10) 用1x PBS洗滌→6x 10分鐘 11) 添加二抗:山羊抗小鼠IgG(H + L),Alexa Fluor 680(在1%BSA / PBS中為1:50)→在4°C過夜 12) 用1x PBS洗滌→6x 10分鐘 13) 加入染色混合物→1x 40分鐘 i) 羅丹明phalloidin染色肌動蛋白絲(PBS中1:400) ii) Hoechst 33342對細胞核染色(1:100,PBS中0.5 μg/ml) 14) 用1x PBS洗滌→6x 10分鐘 15) 將PBS留在儲液罐中并開始成像。 免疫熒光圖像是由共聚焦激光掃描顯微鏡獲得,配以水物鏡。 重要提示:與標準染色方案相比,洗滌和染色步驟所需的培養時間更長。這是為了確保抗體通過凝膠充分擴散。 實驗結果: HUVEC在Matrigel?基質中的免疫染色顯示,相鄰的細胞組優先形成細胞簇并作為集合體遷移。少數細胞呈單細胞遷移。 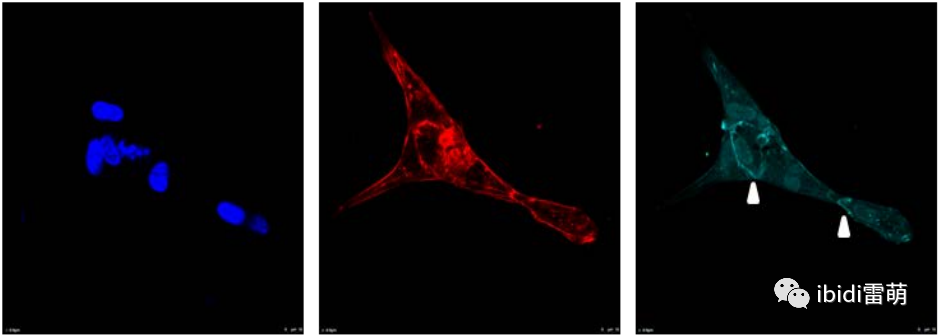 圖中顯示HUVEC在50%Matrigel?中的多細胞趨化性的細胞簇。固定后,對細胞進行細胞核(藍色)、F-肌動蛋白(紅色)和VE鈣粘蛋白(青色)染色。白色箭頭表示VE介導的細胞-細胞接觸。當以多細胞單元組織時,細胞團簇表現出明顯的前后不對稱的群分化。遷移復合體較深區域的連續細胞沒有分化。然而,這些細胞特征性地保留了VE鈣粘蛋白介導的細胞-細胞接觸。 |




