細胞剪切力實驗--流體剪切力為多功能干細胞來源的內皮細胞提供真實的模擬條件
美國的科研人員希望能夠通過誘導多功能干細胞來源的內皮細胞(iPSC-EC)建立一個血管發育的模型。其中,對內皮細胞的剪切力是,血管發育中不可或缺的條件。流體剪切力能夠使細胞排列緊密,有規律。這里以iPSC-EC細胞為例,使用ibidi Pump System 進行一個流動剪切力條件下的細胞培養與靜置狀態下的細胞培養的對比實驗。
一、實驗準備實驗材料及設備
1)細胞: iPSC-EC (CDI, Madison,WI)
2)培養基:VascuLife VEGF Medium(Lifeline Cell Technologies, Frederick, MD)
3)培養耗材:ibidi單通道載玻片μ-Slide I0.6 Luer (ibidi,Germany,80186)
灌流管,15cm,1.6mm直徑(ibidi,Germany,10962)
封口夾
4)儀器設備:德國ibidi流體剪切力系統,含空氣泵(ibidi,Germany,10905)和流體單元(ibidi,Germany,10903)
二、實驗方法
在實驗開始前一天,請將所有需要使用的試劑,培養基,通道載玻片,灌流管都在37℃的二氧化碳培養箱中放置過夜,排除由于溫度差產生的微量氣泡。
一)按照下面流程鋪細胞:
1)將1×105 cells/cm2密度的細胞懸液加入通道載玻片中,注意,將移液器頭插入注液孔中再加入細胞懸液,可以輕微傾斜通道載玻片幫助細胞懸液充滿整個通道(圖一)。
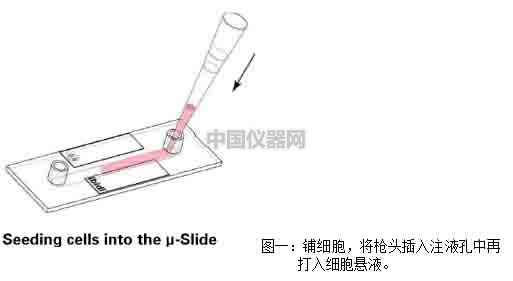
2)蓋上注液孔蓋,將通道載玻片放入細胞培養箱中培養半小時,等待細胞貼壁。細胞貼壁后,拿出通道載玻片,在每個注液孔中分別加入60μl培養基,注意,槍頭要懸在孔上方滴入培養基(圖二)
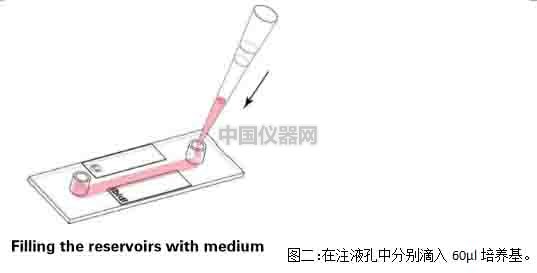
3)將通道載玻片再放入二氧化碳培養箱進行培養2-4小時左右,等到細胞剛剛長滿為單細胞層,即可開始實驗(圖三)。注意,要使用單層細胞進行剪切力實驗,使每個細胞均受到均勻的剪切力。
圖三
4)靜置條件下細胞培養。在通道載玻片中靜置培養的細胞可以作為流體剪切力條件下培養的細胞對照。待流體實驗開始的同時,將靜置細胞培養的對照組放入二氧化碳培養箱中進行72h的培養。注意,培養過程中每天都要更換培養基。
二)搭建流體系統
1)將灌流管按照說明放在置在流體單元上。在灌流管的儲液管中加入12ml培養基。這時不需要連接通道載玻片。實驗前需要去除整個灌流管中的氣泡,存留在灌流系統的氣泡會影響剪切力的大小,有時還會使灌流系統中的液體流動停滯。打開ibidi泵控制系統,在任務欄中找到“Remove air bubbles”,ibidi流體剪切力系統將自動運行下面任務,用于去除氣泡。(表一)

2)連接通道載玻片。去除氣泡后,就可以將之前準備好的含貼壁細胞的通道載玻片與灌流管相連。將搭載灌流管的流體單元從流體剪切力系統中取下,放到超凈臺中。將通道載玻片的注液孔用培養基裝至過滿狀態( )。之后就按照下面的流程圖連接通道載玻片(圖四)。 )。之后就按照下面的流程圖連接通道載玻片(圖四)。

圖四:a)封口夾輕輕將灌流管的硅膠管夾住。b)將其中一個魯爾接頭從中間的鏈接管中拔出。c-j)按圖示,將魯爾接頭與通道載玻片的注液孔相連,注意不能產生氣泡,會有部分培養基溢出。k)連接好后,將封口夾移除,用無塵紙將溢出的培養基擦除。l)全部連接好后,用顯微鏡觀測一下通道內的細胞狀態。
3)檢查灌流系統是否密封、是否將灌流管插入了正確的閥門。將封口夾夾住其中一根硅膠管,如果兩邊的灌流儲液管液面不會下降或者上升,那么,整個系統就是密封的,并且是正確安裝的(圖五)。
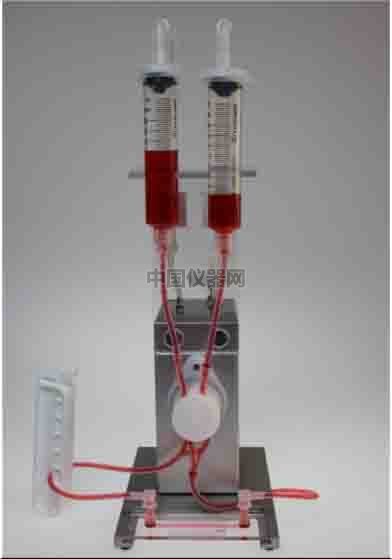
圖五。
4)開始流體剪切力實驗(單向層流)。將搭建好的流體單元與流體剪切力泵相連后,將整個流體單元放入二氧化碳培養箱中。打開控制軟件,設置20 dyn/cm2 培養72h。
三)免疫熒光實驗
1)去除通道內培養基。用1mlPBS沖洗通道,在注入PBS的同時,用槍頭從另一個注液孔吸出廢液。
2)加入約200μl的4%多聚甲醛的PBS溶液,用槍頭從另一個注液孔吸出廢液。靜置10分鐘。
3)按照步驟1)沖洗通道
4)加入200μl 1% Triton® X-100 的PBS 溶液通透3-5分鐘
5)按照步驟1)沖洗通道
6)加入200μl 1% BSA的PBS溶液封閉20分鐘
7)按照步驟1)沖洗通道
8)依次加入一抗,二抗進行免疫熒光染色后,沖洗通道并加入封片液進行顯微鏡觀察。
三 實驗結果
一)形態對比
在培養7天之后,可以直接用顯微鏡觀察到細胞的形態發生了顯著的變化,在剪切力刺激下培養的細胞形態更加修長,排列更加緊密和規律。而靜置狀態下培養了7天的細胞形態沒有顯著的變化(圖六)。
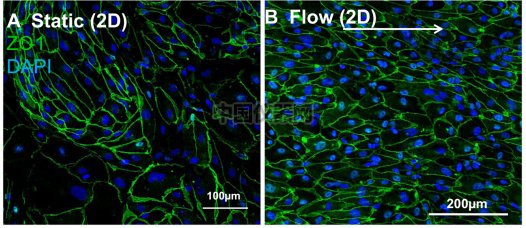
圖六:如上所示,在20 dyn/cm2刺激下的細胞更為修長排列更加緊密。細胞核;藍色;綠色:VE- cadherins。
|




